La
química inorgánica estudia la composición, formación, estructura y las
reacciones químicas de los elementos y los compuestos inorgánicos, es
decir, realiza los estudios de todos aquellos compuestos en los que no
participan los enlaces carbono-hidrógeno. Los compuestos inorgánicos
existen en menor proporción en cantidad y variedad que los compuestos
orgánicos.
Nomenclatura sistemática Esta es el primer tipo de nomenclatura que se basa en nombrar los compuestos usando prefijos numericos griegos que indican la atomicidad de cada uno de los elementos presentes en cada molécula. La atomicidad tiene como objetivo indicar el número de átomos de un mismo elemento en una molécula. En la nomenclatura química se considera a la atomicidad como el número de átomos de un elemento en una sola molécula. La forma de nombrar los compuestos en este sistema es: prefijo-nombre genérico + prefijo-nombre específico. Prefijos griego – numero de atomos mono- 1 di- 2 tri- 3 tetra- 4 penta- 5 hexa- 6 hepta- 7 oct- 8 non- nona- eneá- 9 deca- 10 Por ejemplo, H2O= Óxido de Dihidruro ; CO = Monóxido de Carbono 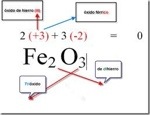 Nomenclatura stock consiste en nombrar a los compuestos escribiendo al final del nombre con números romanos la valencia atómica del elemento. indicando el número de electrones que un átomo pone para que se pueda ceder en un enlace químico. De forma general, bajo este sistema de nomenclatura, los compuestos se nombran de esta manera: nombre genérico + de + nombre del elemento específico + el No. de valencia. Los números de valencia normalmente se colocan como superíndices del átomo (elemento) en una fórmula molecular. Ejemplo: Mn2O7, Óxido de Manganeso (VII). Nomenclatura tradicional En este sistema de nomenclatura se indica la valencia del elemento de nombre específico con una serie de prefijos y sufijos. De manera general las reglas son:
--------------------------------------------------------------------------------------------------------- Hoy os dejo un vídeo sobre el átomo. Está animado y entretenido. Merece la pena verlo. https://www.youtube.com/watch?v=p59iyE1aVoo ¡Hasta pronto! -------------------------------------------------------------------------------------------------------- Teoría cinética de los gases La Teoría Cinética de los Gases explica el comportamiento de los gases utilizando un “modelo” teórico. Suministra un modelo mecánico el cual exhibe propiedades mecánicas promedias , que están identificadas con propiedades macroscópicas, es decir que impresionan nuestros sentidos, tales como la presión. En este modelo , una sustancia gaseosa pura consiste del agregado de un número muy grande de partículas independientes llamadas moléculas, que son muy pequeñas, perfectamente elásticas y están moviendose en todas direcciones. Para este sistema rige perfectamente la fisica clásica. Una mayor división de las moléculas no es posible porque tal división guiaría a una transformación química de la sustancia gaseosa. Los postulados de esta teoría son los siguientes: |
| ----------------------------------------------------------------------------------------------------- |
La ciencia y la medida
La física y la química son ciencias experimentales porque su información la obtienen de los datos que consiguen mediante las medidas. Miden:
-Las propiedades de los cuerpos. Ejemplo: 2 kg (masa).
-Las características de la materia. Ejemplo: 26 K (grados kelvin).
-Los cambios que experimentan los cuerpos y los materiales. Ejemplo: Dilatación 3mm.
Magnitud y unidad
Las magnitudes físicas son aquellas propiedades y cualidades de la materia que se pueden medir. Medir es comparar una magnitud con una cantidad que llamamos unidad para ver cuantas veces la contiene. El número de veces que la contenga es lo que mide.
El resultado de una medida se expresa siempre mediante un número seguido de una unidad.
Unidad
Es una cierta cantidad de una magnitud que se toma como referencia y a la que se le asigna el valor uno. Es una cantidad arbitraria reconocida internacionalmente.
Magnitudes fundamentales y derivadas
De acuerdo con los convenios internacionales, todas las magnitudes se pueden clasificar en dos tipos:
-Fundamentales: Se pueden medir con un instrumento de medida. Ejemplo: Longitud y masa.
-Derivadas: Se expresan a partir de las fundamentales mediante una fórmula o ecuación matemática y haciendo operaciones.
Sistema internacional
Fue establecido en el año 1960 para facilitar la comunicación internacional. Es un conjunto de magnitudes fundamentales y derivadas con sus unidades. Son siete magnitudes fundamentales y las demás derivadas.
Magnitudes fundamentales
Longitud: Se representa con la letra l y su unidad es el metro (m).
Masa: Se representa con una m y su unidad es el kilogramo (kg).
Tiempo: Se representa con una t y su unidad es el segundo (s).
Temperatura: Se representa con una t y su unidad es el grado kelvin (K).
Intensidad de corriente: Se representa con una I y su unidad es el amperio (A).
Luminiscencia: Se representa con Iv y su unidad es la candela (cd).
Cantidad de sustancia: Se representa con n y su unidad es el mol (mol).
Magnitudes derivadas
| Magnitud | Nombre | Símbolo |
| Área, superficie | Metro cuadrado | m2 |
| Volumen | Metro cúbico | m3 |
| Velocidad | Metro por segundo | m/s |
| Aceleración | Metro por segundo cuadrado | m/s2 |
| Número de ondas | Metro a la potencia menos uno | m-1 |
| Densidad, masa en volumen | Kilogramo por metro cúbico | kg/m3 |
| Densidad superficial | Kilogramo por metro cuadrado | kg/m2 |
| Volumen específico | Metro cúbico por kilogramo | m3/kg |
| Densidad de corriente | Amperio por metro cuadrado | A/m2 |
| Concentración de cantidad de sustancia, concentración | Mol por metro cúbico. | mol/m3 |
| Concentración másica | Kilogramo por metro cúbico | kg/m3 |
| Luminiscencia | Candela por metro cuadrado. | cd/m2 |
Aquí dejo unas URL con contenido sobre el tema, un saludo.
http://www.profesorenlinea.cl/fisica/MedidasSistema_internacional.htmhttp://www.sc.ehu.es/sbweb/fisica_/unidades/unidades/unidades_1.html
No hay comentarios:
Publicar un comentario